Crispr (si pronuncia Crisper) è l'acronimo di Clustered Regularly Interspaced Short Palindromic Repeats, letteralmente tradotto in "sequenze ripetute palindrome brevi raggruppate a intervalli regolari", ed è associato a una famiglia di segmenti di Dna che contengono brevi sequenze ripetute.
Nonostante sia un argomento molto specifico (e anche un po' ostico a prima vista) la conoscenza e l'utilizzo di questa tecnica genetica può aiutare l'agricoltura a ottenere nuove piante con conseguenti novità per quanto riguarda le tecniche colturali e il panorama varietale, e quindi anche il lavoro dell'agricoltore.
Al punto che anche Crispr nel suo piccolo ha una sua giornata mondiale che è oggi venerdì 20 ottobre, ed è indetta da Synthego, una corporation statunitense che punta a raccogliere la comunità di ingegneri genomici proveniente da tutto il mondo.
Questa tecnica ha molte applicazioni soprattutto in campo medico ma in questo articolo partiremo dalle definizioni della Treccani per vedere come viene usata anche in agricoltura. L'obiettivo finale di queste ricerche è ottenere nel minor tempo possibile cultivar più produttive, più sane e più adattabili all'ambiente.
Dna: "È un polimero informazionale che fa parte della classe degli acidi nucleici, componenti fondamentali delle strutture viventi, è costituito da uno zucchero, un gruppo fosfato, una base azotata. Le quattro basi presenti nel Dna sono guanina, adenina, citosina e timina. L'informazione genetica è resa possibile dalla pressoché infinita possibilità combinatoria del susseguirsi delle quattro basi azotate".
Le brevi sequenze ripetute, contenute in segmenti di Dna di alcuni geni, sono posizionate in una specifica porzione del segmento: il locus Crispr. Questa famiglia di segmenti è stata scoperta in organismi molto semplici come i batteri.
Come funziona Crispr?
I batteri utilizzano Crispr per riconoscere e distruggere il genoma di virus patogeni, funzionando così da immunità adattativa per il batterio stesso.
Per immunità adattativa si intende una risposta immunitaria da parte dell'organismo attaccato caratterizzata dal suo adattamento a ciascun agente parassita. In poche parole, con Crispr il batterio sviluppa ogni volta una "vaccinazione" naturale contro i patogeni che vivono nel suo stesso ambiente.
I sistemi Crispr sono divisi in tre tipi principali: tipo 1, tipo 2 e tipo 3 e in dodici sottotipi che si differenziano fra di loro in base al loro contenuto genetico e alla loro struttura. Inoltre, sono accompagnati da un corredo di geni omologhi, più comunemente conosciuti come "geni Cas". Dalla trascrizione di questi geni derivano specifiche proteine (o enzimi) definite appunto "proteine Cas".
E sono proprio i geni Cas che differenziano i diversi tipi di Crispr: Cas1 e Cas2 sono universali per tutti i tipi e sottotipi; mentre Cas3, Cas9 e Cas10 si trovano rispettivamente nel tipo 1, 2 e 3.
Gli studi pionieristici su questo sistema genico sequenziarono all'inizio 4 geni Cas (Cas1, Cas2, Cas3, Cas4). Man mano che gli studi proseguirono furono sequenziati altri geni ed altrettante proteine associate come, ad esempio, la famosa Cas9 di cui parleremo fra un attimo.
Sequenziamento: "In biologia molecolare è la determinazione esatta della posizione delle basi azotate di un acido nucleico, come il Dna, oppure degli amminoacidi come le proteine".
Cas9, un enzima "ricorda e taglia"
Vediamo ora che cos'è e come funziona l'enzima Cas9, una proteina associata al sistema Crispr. Cas9 è un enzima con un Rna guida, composto da due molecole, coinvolto nell'immunità adattativa Crispr.
Rna: "È un acido nucleico coinvolto in vari ruoli biologici quali codifica, regolazione ed espressione genica, in particolare la sintesi di proteine".
A cosa serve Crispr/Cas9?
Cerchiamo di spiegare in maniera semplificata come funziona questo complesso all'interno della cellula.
Quando il batterio ospite viene attaccato da un'infezione virale l'Rna guida funziona come una bussola e conduce l'enzima Cas9 verso il Dna target. Se ci sono 20 paia di basi azotate complementari fra l'Rna guida e il Dna patogeno, l'enzima Cas9 si lega a quest'ultimo e lo taglia come delle vere e proprie "forbici molecolari".
In questo modo la cellula ospite blocca la virulenza del patogeno e si protegge.
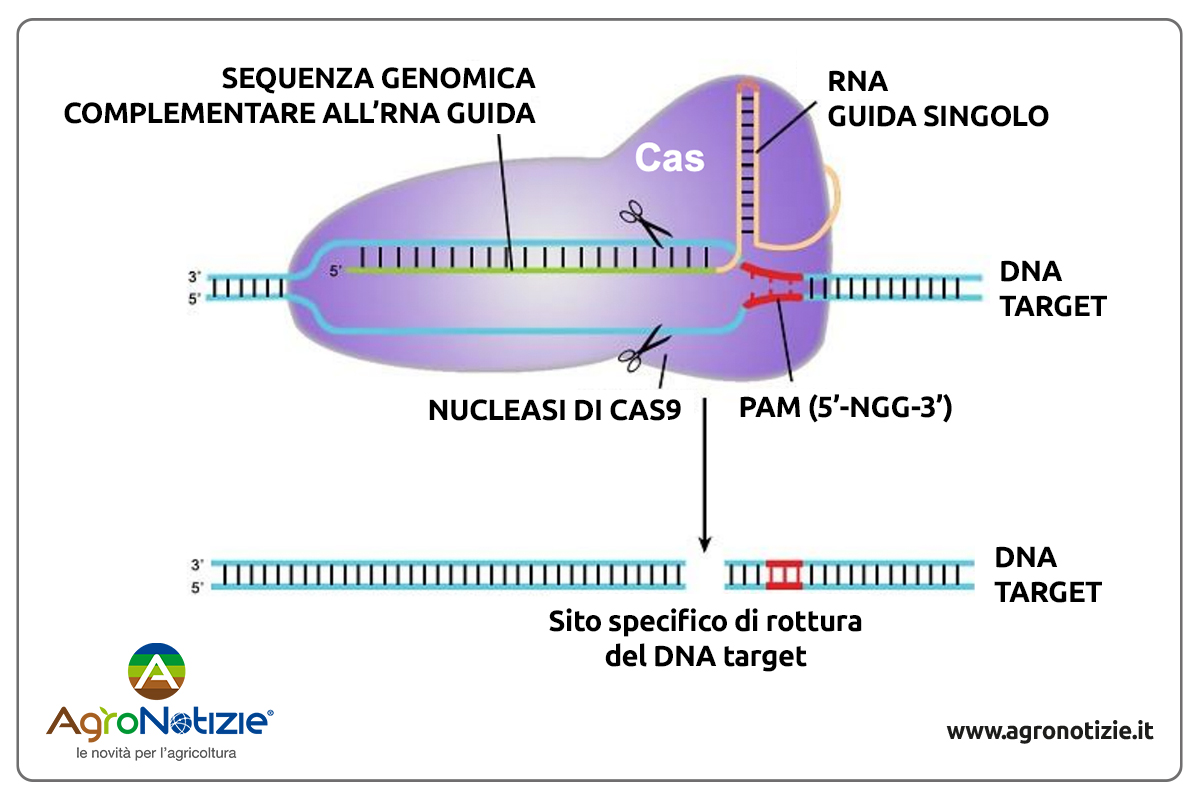
Il complesso Crispr/Cas9 viene trasportato dall'Rna guida sul Dna target e quando il sistema trova le basi azotate complementari la proteina Cas9 taglia il sito specifico (Foto di archivio)
(Fonte: AgroNotizie®)
Il complesso Crispr/Cas9 ha permesso di aprire una nuova strada all'ingegneria genetica consentendo di apportare distinte modifiche al genoma di una cellula.
Ingegneria genetica: "È l'insieme di tecnologie che permettono la manipolazione in vitro di molecole di Dna, in modo da provocare cambiamenti predeterminati nel genotipo di un organismo. Con queste manipolazioni è possibile produrre nuove combinazioni di geni, determinare specifiche mutazioni, introdurre geni in cellule che possono esprimere nuove funzioni".
Questo meccanismo avviene in maniera del tutto naturale nei batteri, ma come si è riusciti a utilizzarlo in laboratorio?
Il "taglia e cuci" nell'editing genomico
Le ricercatrici Jennifer Doudna e Emmanuelle Charpentier hanno ingegnerizzato questa "forbice molecolare" naturale creando un unico Rna guida e facilitando così l'utilizzo di Cas9.
Con l'ingegnerizzazione di Crispr/Cas9 si può tagliare in maniera molto precisa un Dna target, eliminando o aggiungendo una o più basi azotate, nella porzione di genoma interessata ottenendo così nuove caratteristiche fisiologiche e morfologiche negli organismi modello.
Questo perché modificando l'informazione genetica si possono ottenere nuovi tipi di proteine e quindi nuove risposte (fisiologiche e morfologiche) per risolvere uno specifico stress. Per esempio, con l'editing genomico si sono ottenuti semi di cotone privi di aldeidi, eliminando così la pericolosità di questa molecola per l'uomo, e consentendone la commestibilità.
Per poter modificare il gene target il complesso Crispr/Cas9 deve essere trasportato nella cellula da un vettore. Si sono svolte diverse prove per trovare e migliorare le diverse strategie di trasporto di Crispr, al fine di superare diversi limiti biologici e facilitarne l'uso nell'editing genomico. Al momento possiamo classificare il trasporto in base ai vettori utilizzati: trasporto basato su vettori virali, trasporto basato su meccanismi non virali e trasporto basato su metodi fisici.
Editing genomico: "È un tipo di ingegneria genetica in cui è possibile modificare o sostituire piccole parti della sequenza di un Dna. L'editing genomico, quindi, agisce in siti ben specifici a differenza delle prime tecniche di ingegneria genetica che inserivano in maniera casuale materiale genetico in un genoma ospite".
La proteina Cas9 è formata da due siti di taglio (Hnh e RuvC) specifici per i due filamenti che compongono la doppia elica di Dna. Il team di ricerca di Jennifer Doudna e Emmanuelle Charpentier ha dimostrato che è possibile disattivare a piacimento entrambi o solo uno di questi siti di taglio. La disattivazione di Hnh e/o di RuvC non disattiva la capacità di Cas9 di legarsi al Dna target consentendo al ricercatore di decidere quale filamento della doppia elica tagliare aggiungendo estrema flessibilità alla tecnica.
Gli studi hanno dimostrato che le modifiche con Crispr/Cas9 possono essere applicate in molte specie di organismi come lieviti, anfibi, piante (Arabidopsis thaliana) e mammiferi.
È bene ricordare però che l'applicazione di questa tecnica avviene al momento all'interno dei laboratori dei centri di ricerca e nelle università nell'attesa che il legislatore inquadri queste nuove tecniche in un quadro normativo adeguato a questo tipo di attività. Solo allora queste tecniche potranno mostrare il proprio effettivo potenziale.























