Il 2023 è stato segnato dal dibattito sull'immissione nel mercato delle carni coltivate, cioè cellule di animali vertebrati fatte riprodurre all'interno di appositi bioreattori, dalle quali si ricava una specie di hamburger avente le stesse proprietà nutrizionali della carne.
Leggi anche Le carni coltivate, fra realtà e narrazione
Il punto finale alle discussioni - almeno in Italia - è avvenuto con l'approvazione della Legge 1 dicembre 2023, n. 172 "Disposizioni in materia di divieto di produzione e di immissione sul mercato di alimenti e mangimi costituiti, isolati o prodotti a partire da colture cellulari o di tessuti derivanti da animali vertebrati nonché di divieto della denominazione di carne per prodotti trasformati contenenti proteine vegetali".
Le motivazioni per produrre "proteine nobili" eliminando gli allevamenti di bestiame sono variegate: c'è chi invoca motivi etici o morali, chi gli odori, i gas serra e l'inquinamento da nitrati, chi invece intravede un futuro distopico nel quale il cibo scarseggerà per mancanza di spazio produttivo, e perfino qualcuno che intravede un "sistema autotrofico portatile" che consentirà i viaggi spaziali e la colonizzazione di Marte nel giro di poche decadi. Eppure l'idea non è nuova ed esiste a livello commerciale da decenni. Si tratta delle "proteine unicellulari".
Benché non le chiamasse ancora "proteine unicellulari", durante la Prima Guerra Mondiale la Germania produceva grandi quantità di lievito di birra (Saccharomyces cerevisiae) da impiegare come supplemento proteico per la popolazione ridotta alla fame, utilizzando il melasso residuale della produzione di zucchero di barbabietola (1). Il primo utilizzo documentato del termine "single-cell proteins" risale ad un paper del Mit, il Massachusetts Institute of Technology, del 1966 ed è il titolo di un libro del 1985 (2). Dal sito ufficiale della Commissione Europea è possibile scaricare gli atti di un convegno tenutosi a Zurigo nel 1983 (3).
Perché tanto interesse di lunga data per questo argomento? Noi umani abbiamo bisogno di "proteine nobili", cioè quelle che contengono gli amminoacidi essenziali che il nostro organismo non può sintetizzare, i quali solitamente sono assenti - o presenti in piccole concentrazioni - nelle sostanze vegetali. Il problema di fondo dell'era moderna è che la popolazione cresce rapidamente, ma l'efficienza di conversione dei mangimi in proteine nobili è molto bassa (Foto 1), quindi servono maggiori estensioni di terra coltivabile. Di conseguenza, gli scenari possibili sono catastrofistici (dal semplice aumento della povertà e delle migrazioni di massa fino al genocidio globale in seguito al collasso degli ecosistemi), fantascientifici (colonizzazione della Luna e di Marte) o adattativi (i prodotti animali vengono sostituiti con prodotti alternativi).
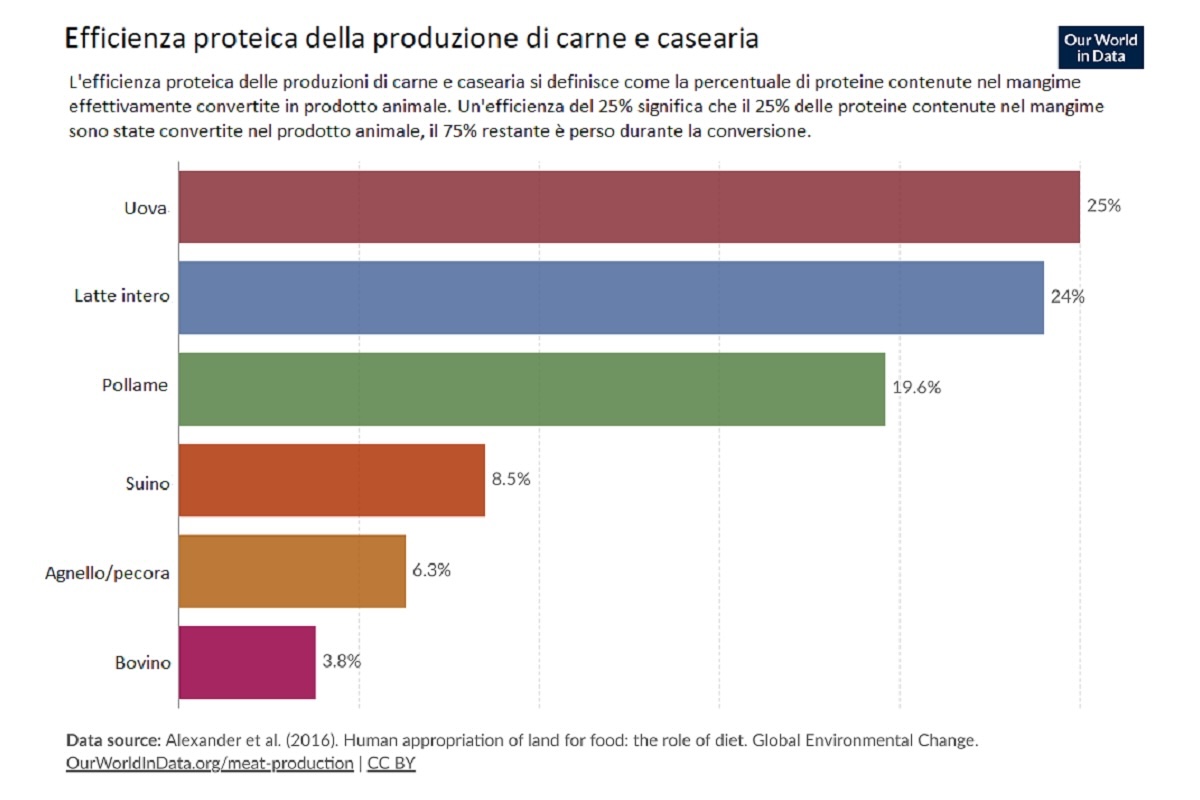
Foto 1: Efficienza di conversione dei mangimi proteici in proteine nobili
(Fonte foto: Elaborazioni di Our World in Data, su dati tratti da (4). Traduzione dall'inglese dell'autore)
Le alternative alle proteine di origine animale tradizionali sono dunque le proteine di insetti, di specie vegetali alternative, la carne coltivata e la produzione di proteine da organismi unicellulari. I candidati più papabili fra questi ultimi sono lieviti, muffe, cianobatteri e batteri. Il loro consumo sarebbe culturalmente più accettabile rispetto alle altre opzioni perché gli umani consumano da millenni prodotti contenenti biomassa microbica: yogurt, pane, birra, crauti, formaggi, eccetera.
I suddetti microrganismi accomunano tre interessanti caratteristiche:
- sono in grado di riprodursi molto velocemente (alghe e muffe raddoppiano la loro biomassa in due-sei ore; batteri e lieviti in 0.33-due ore);
- hanno un tenore proteico elevato, compresso fra il 30% e l'80% su base secca a seconda della specie;
- si nutrono di svariate sostanze di scarto o si possono manipolare geneticamente per tale scopo.
Quest'ultima caratteristica è un vantaggio dal punto di vista economico e operativo, ma nell'Europa delle Organizzazioni Non Governative (Ong) "no tutto" e della "rifiuto fobia" apre la possibilità di riaprire il dibattito sull'annosa questione del cibo, l'energia e la contaminazione - reale o immaginaria - del cibo. Con la revisione della Red I (Renewable Energy Directive), la Red II aveva ridimensionato gli obiettivi di produzione dei biocarburanti di prima generazione (quelli che utilizzano sostanze edibili e quindi, nell'opinione di molti, mettono a repentaglio la sicurezza alimentare). La Red III doveva eliminare i biocarburanti di prima generazione entro il 2030, ma a quanto pare la Commissione Europea ci ha ripensato.
Leggi anche Biocarburanti Vs e-fuel: cosa dice veramente la Red III
In linea di massima, la produzione di biocarburanti e biomateriali utilizzando sostanze di scarto - rifiuti o sottoprodotti che siano - dovrebbe essere una soluzione accettabile perfino per gli ambientalisti più sfegatati. Ciò nonostante, qualcosa di ovvio ed ecocompatibile come il riutilizzo in agricoltura delle acque trattate è ancora quasi impossibile da attuare per dei cervellotici tecnicismi.
Provate dunque ad immaginare la reazione dei gruppi politici "verdi" se anche i rifiuti e i sottoprodotti che oggi vengono destinati agli impianti di biogas diventassero materie prime accettabili per la produzione di proteine alimentari, ad uso umano o animale. Ci vorrebbe una Red IV in tempi record. Possiamo scongiurare l'ennesimo atto di iper regolamentazione europea perché, stando alle ricerche più moderne e almeno in teoria, sarebbe possibile produrre simultaneamente biogas e proteine unicellulari.
Esistono tre diversi approcci per raggiungere una tale quadratura del cerchio, più una quarta opzione più "purista" che mira alla conversione del biogas stesso in proteine:
- Utilizzare l'anidride carbonica del biogas o dei fumi degli impianti di combustione, assieme a dell'idrogeno verde o al syngas, per coltivare batteri (5). Questo approccio è sostanzialmente identico alla fermentazione del syngas già trattata nel precedente articolo, con in più uno stadio per il recupero della biomassa batterica. Attualmente è in corso il progetto di ricerca SynoProtein, finanziato dall'Unione Europea, che si propone come obiettivo quello di raggiungere una produttività di 5 chilogrammi di proteina/m3 di reattore.ora.
- Utilizzare lieviti e muffe per pretrattare sostanze vegetali difficilmente digeribili, recuperando le proteine e valorizzando il residuo come biogas (6 e 7).
- Utilizzare il separato liquido del digestato con l'aggiunta di acque residue dall'industria dolciaria per coltivare lieviti o batteri, tutto adeguatamente sterilizzato, come medio di coltura di lieviti (8).
- Utilizzare biometano per coltivare batteri metanotrofi, dai quali ricavare le proteine.
Questo processo è stato sviluppato su scala industriale a cavallo fra gli Anni Settanta e Ottanta del Ventesimo Secolo, ma utilizzando gas naturale, ammoniaca, una soluzione con sali minerali e ossigeno come ingredienti. I Paesi dove è stato implementato sono Russia, Inghilterra, Francia, Germania, Norvegia e Italia. In Norvegia, il prodotto si chiamava Bioprotein ed il suo scopo era alimentare la mastodontica industria norvegese degli allevamenti di salmone. Il bioreattore funzionava a 45°C e la produttività era di 4 chilogrammi di proteine/m3 di reattore.ora (9). In Italia, invece, il prodotto si chiamava Liquipron ed era orientato alla produzione di mangime per pollame. Il progetto era della Liquichimica di Reggio Calabria, basato su un brevetto russo, ma l'azienda chiuse i battenti pochi mesi dopo l'apertura.
In una versione moderna, testata solo a scala pilota, il biogas in uscita da un digestore convenzionale viene sottoposto a bioupgrading in un bioreattore al quale viene aggiunto idrogeno, ed il biometano risultante alimenta un secondo bioreattore dove si coltivano i batteri proteici (10).
In un'altra variante proposta, le proteine provengono dalle colture di batteri metano-ossidanti e zolfo-ossidanti, utilizzando appunto il CH4 e l'H2S del biogas (11).
Dai fatti esposti si desume che la produzione di proteine unicellulari ha molte caratteristiche che la rendono più sostenibile della carne coltivata. La coltivazione di batteri e lieviti è pure più semplice di quella di cellule di animali e, con i necessari adattamenti culturali ed investimenti, più affine all'attività agricola. Le possibilità di integrazione con impianti di biogas o biomasse, agricoli o industriali, sono molteplici e consentirebbero il raggiungimento del paradigma dell'economia circolare tanto sbandierato dalla Commissione Europea.
Eppure, è la stessa Commissione Europea che con il suo eccesso di regolamentazione impedisce, o quanto meno limita fortemente, gli investimenti in questo settore. Dimostrazione: alla data attuale, esistono almeno diciassette produttori industriali di proteine unicellulari attivi, dei quali solo due nell'Unione Europea (Belgio e Francia, 1 già citato). Aggiungiamo che il paper in questione non cita un'altra fonte di proteine unicellulari, la coltivazione di spirulina in acque fognarie trattate o perfino urina umana, attualmente operativa in Africa e Asia. Pratica che la Commissione Europea vieta severamente, ma non vieta l'importazione di tali prodotti, che vengono venduti nel nostro mercato a prezzi astronomici. Vedremo un giorno gli agricoltori italiani diventare "allevatori di batteri"?
Bibliografia
(1) Bajic B, Vucurovic D, Vasic Ð, Jevtic-Mucibabic R, Dodic S. Biotechnological Production of Sustainable Microbial Proteins from Agro-Industrial Residues and By-Products. Foods. 2022 Dec 25;12(1):107. PMID: 36613323; PMCID: PMC9818480.
(2) Goldberg I. Single Cell Protein. Springer; Berlin, Germany: 1985. p. 3.
(3) European Commission, Ferranti, M., Fiechter, A., Production and feeding of single cell protein - Proceedings of the COST workshop 83-84, Zuerich, CH, 13-14 April 1983 Main headings: 1. Pretreatment and degradation of lignocelluloses 2. Production of SCP from cellulosic materials 3. SCP from whey 4. Nutrition and toxicity, Publications Office, 1983.
(4) Peter Alexander, Calum Brown, Almut Arneth, John Finnigan, Mark D.A. Rounsevell, Human appropriation of land for food: The role of diet, Global Environmental Change, Volume 41, 2016, Pages 88-98, ISSN 0959-3780.
(5) Yufeng Jiang, Xiaoyong Yang, Danfei Zeng, Yanyan Su, Yifeng Zhang, Microbial conversion of syngas to single cell protein: The role of carbon monoxide, Chemical Engineering Journal, Volume 450, Part 2, 2022, 138041, ISSN 1385-8947.
(6) Myrsini Sakarika, Brecht Delmoitié, Eleftheria Ntagia, Ioanna Chatzigiannidou, Xavier Gabet, Ramon Ganigué, Korneel Rabaey, Production of microbial protein from fermented grass, Chemical Engineering Journal, Volume 433, Part 2, 2022, 133631, ISSN 1385-8947.
(7) Fernandez, Maria Santamaria (2018) A Novel Green Biorefinery Concept: Protein refining by lactic acid fermentation and biogas production from green biomass. PhD thesis, Aalborg University , Chemistry and Bioscience.
(8) Bertasini D., Binati R.L., Bolzonella D., Battista F. Single cell proteins production from food processing effluents and digestate. Chemosphere. 2022;296:134076.
(9) Lackner, Maximilian, David Drew, Valentina Bychkova, and Ildar Mustakhimov. 2022. "Value-Added Products from Natural Gas Using Fermentation Processes: Products from Natural Gas Using Fermentation Processes, Part 2". Natural Gas - New Perspectives and Future Developments. IntechOpen.
(10) Kerckhof F-M, Sakarika M, Van Giel M, Muys M, Vermeir P, De Vrieze J, Vlaeminck SE, Rabaey K and Boon N; (2021) From Biogas and Hydrogen to Microbial Protein Through Co-Cultivation of Methane and Hydrogen Oxidizing Bacteria. Front. Bioeng. Biotechnol. 9:733753.
(11) Marica Areniello, Silvio Matassa, Giovanni Esposito, Piet N.L. Lens, Microbial protein production from sulfide-rich biogas through an enrichment of methane- and sulfur-oxidizing bacteria, Bioresource Technology, Volume 383, 2023, 129237, ISSN 0960-8524.






















