Funghi, lieviti e muffe sono organismi che appartengono al regno Fungi (plurale dal latino fungus). Si caratterizzano per: l'alimentazione eterotrofa (ovvero si nutrono di sostanze prodotte da altri organismi), la mancanza di tessuti differenziati, la riproduzione mediante spore e le pareti cellulari costituite da chitina (un polisaccaride più resistente della cellulosa).
I funghi accumulano riserve sotto forma di glicogeno, un polimero del glucosio. Esistono funghi unicellulari e pluricellulari, che a loro volta possono essere aerobici, facoltativi e anaerobici. Tale biodiversità, unita al fatto che in genere si tratta di organismi che si riproducono velocemente, rende questi esseri particolarmente interessanti per applicazioni biotecnologiche.
In questo articolo analizzeremo le tecnologie più mature basate sui Fungi (intesi come categoria tassonomica): la fermentazione alcolica e la produzione di enzimi.
La fermentazione alcolica è uno dei bioprocessi più antichi - forse il più antico in assoluto - noti all'umanità.
I lieviti più utilizzati per la produzione di etanolo sono:
- Saccharomyces cerevisiae o "lievito di birra". È il lievito più utilizzato nella produzione di bevande alcoliche, alcol industriale (alcuni ceppi sopravvivono a concentrazioni di alcol maggiori del 14%) e pane. Esistono un'infinità di ceppi commerciali.
- Saccharomyces ellipsoideus, cresce spontaneamente sull'uva ed è responsabile della fermentazione del mosto.
I lieviti del genere Saccharomyces sono in grado di fermentare l'esosio (zuccheri con sei atomi di carbonio) ma non il pentosio (zuccheri con cinque atomi di carbonio). - Pichia stipitis, un lievito che vive sul legno in decomposizione e in simbiosi con le larve di insetti che abitano il legno. È in grado di fermentare glucosio (zucchero d'uva o d'amido), xilosio (zucchero con cinque atomi di carbonio, costituente dell'emicellulosa), galattosio (stessa formula chimica del glucosio) e cellobiosio in condizioni anaerobiche. Pichia stipitis ha la più alta capacità nativa di fermentazione dello xilosio tra i microbi conosciuti, ma il glucosio inibisce il trasporto dello xilosio in modo non competitivo. Inoltre, P. stipitis ha una minore resistenza all'etanolo rispetto a S. cerevisiae e il controllo dell'ossigeno disciolto a bassi livelli è di grande importanza per un'elevata resa di etanolo (1).
I lieviti sono incapaci di fermentare direttamente l'amido, il quale deve prima essere saccarificato. In Occidente questo avviene tradizionalmente mediante la produzione del malto, mentre in Oriente si ricorre ad un fungo filamentoso aerobico (cioè una muffa), l'Aspergillus oryzae, chiamato koji in giapponese. Nella produzione di sakè, il riso bollito viene prima saccarificato dal koji, e l'aggiunta successiva del lievito S. cerevisiae trasforma il brodo saccarino nella bevanda alcolica tipica giapponese.
La produzione di bioetanolo a partire da sostanze saccarine o amidacee, cioè alimentari, non è sostenibile. Le direttive europee (Red II, ormai in fase di sostituzione con la Red III) richiedono dunque che i biocarburanti rientrino nella categoria "di seconda generazione", cioè prodotti con sostanze di scarto. La materia prima più idonea per la sua abbondanza e il basso costo è la lignocellulosa dei residui colturali e forestali: paglia, stocchi, pula e ramaglie.
La lignocellulosa è un substrato complesso composto da tre frazioni: cellulosa, emicellulosa e lignina. Ad esempio, il contenuto di cellulosa nella biomassa di conifere è del 18-42%; l'emicellulosa è del 15-27%; il contenuto di lignina è del 30-60%. Per quanto riguarda la biomassa di latifoglie, il contenuto di cellulosa è più alto: 22-45%; l'emicellulosa è del 20-38% e il contenuto di lignina è del 20-55%. La cellulosa e l'emicellulosa sono polisaccaridi costituiti da diversi monomeri di carboidrati fermentescibili come glucosio, galattosio, xilosio, arabinosio, eccetera. Al contrario, la lignina ha una complessa struttura molecolare di catene polimeriche reticolate da monomeri fenolici che possono essere utilizzate per la produzione di sostanze chimiche come resine e colle, ma non di alcol.
Il pretrattamento della biomassa è un passo significativo nella produzione di bioetanolo di seconda generazione. A tal fine, la combinazione di macinazione fisica e biodegradazione della matrice lignocellulosica recalcitrante è considerata una tecnologia rispettosa dell'ambiente. È possibile saccarificare la lignocellulosa mediante un trattamento con acido solforico, ma si formano anche composti nocivi per i lieviti che limitano la produttività di etanolo. È dunque preferibile ricorrere al trattamento con enzimi, che converte selettivamente la cellulosa in zuccheri.
Ad esempio, Trichoderma reesei è un fungo mesofilo filamentoso tipico dei suoli boschivi che si nutre di materia vegetale morta (2). È il fungo più utilizzato per produrre enzimi cellulasi ed emicellulasi su scala commerciale. T. reesei idrolizza i polisaccaridi attraverso i suoi enzimi extracellulari. Inoltre, T. reesei ha dimostrato alti livelli di produzione di questi enzimi di degradazione della biomassa e ha mostrato un buon adattamento alle colture in bioreattore. Precedenti studi hanno dimostrato che T. reesei può depolimerizzare la lignina, ridurre la struttura cristallina della cellulosa e idrolizzare l'emicellulosa. Pertanto, T. reesei consente il rilascio di monosaccaridi fermentescibili che sono normalmente utilizzati da altri microrganismi, come appunto S. cerevisiae e P. stipitis.
Esistono due modelli produttivi per l'etanolo di seconda generazione:
- Modello lineare a tre fasi: estrazione degli enzimi, saccarificazione e fermentazione. In questo modello gli enzimi vengono estratti in uno stabilimento specializzato nella loro produzione, ed adoperati come ingrediente industriale nella distilleria, dove la biomassa viene prima saccarificata ed il "liquore" risultante fermentato e distillato. Con questo approccio, una parte significativa del margine commerciale rimane al produttore degli enzimi.
- Fermentazione tandem (3). Recentemente è stato suggerito un nuovo metodo biotecnologico, denominato tecnologia "Small Bioreactor Platform" (Sbp). In questo metodo, le colture di T. reesei e S. cerevisiae vengono incapsulate e collocate nello stesso bioreattore, alimentato con la biomassa lignocellulosica. Man mano che il fungo digerisce la biomassa, secerne enzimi in abbondanza, e i lieviti convertono in etanolo l'eccesso di zuccheri risultante.
Gli enzimi estratti da funghi vengono proposti come potenziatori della digestione anaerobica. La loro efficacia è dubbiosa e va valutata caso per caso. Da una parte, i microrganismi che costituiscono l'inoculo anaerobico sono già in grado di digerire la cellulosa e l'emicellulosa, quindi l'aggiunta di cellulasi (nota anche come endoglucanasi) non aumenta il Potenziale Metanigeno (Bmp), semplicemente accelera il processo.
Una ricerca a cui ha partecipato l'autore (4) ha dato i risultati mostrati nella Foto 1. Si osserva una produzione anomala di metano verso la fine del processo, nota come diauxia, cioè un gradino nella curva prima del raggiungimento del plateau. Il motivo di tale andamento è che i batteri hanno digerito prima le componenti leggere - risultanti dall'azione degli enzimi sulla cellulosa e l'emicellulosa - fino ad esaurirle, per passare a consumare le componenti più recalcitranti - cioè più difficili da digerire - verso la fine. L'aumento del Bmp prodotto dal trattamento enzimatico può sembrare spettacolare (circa 30% in più), ma il costo di tale trattamento (produzione, trasporto e stoccaggio degli enzimi, più 48 ore di pretrattamento a 40°C con agitazione) potrebbe non giustificare economicamente la maggiore resa di metano. Inoltre, il margine d'incertezza della prova è risultato dell'ordine del 20% (tipico nelle prove di Bmp di sostanze eterogenee come gli insilati), per cui la differenza significativa sarebbe, nel peggiore dei casi, di solo il 10%.
Nel caso del digestato l'aumento di Bmp è modesto perché, per definizione, nel digestato non rimane quasi niente di materiale ancora digeribile, a dimostrazione che i batteri indigeni dell'inoculo hanno già una loro capacità di autoprodurre gli enzimi necessari per degradare la cellulosa e l'emicellulosa. Va inoltre osservato che gli enzimi utilizzati per questa prova erano stati ottenuti da batteri transgenici e non da funghi.
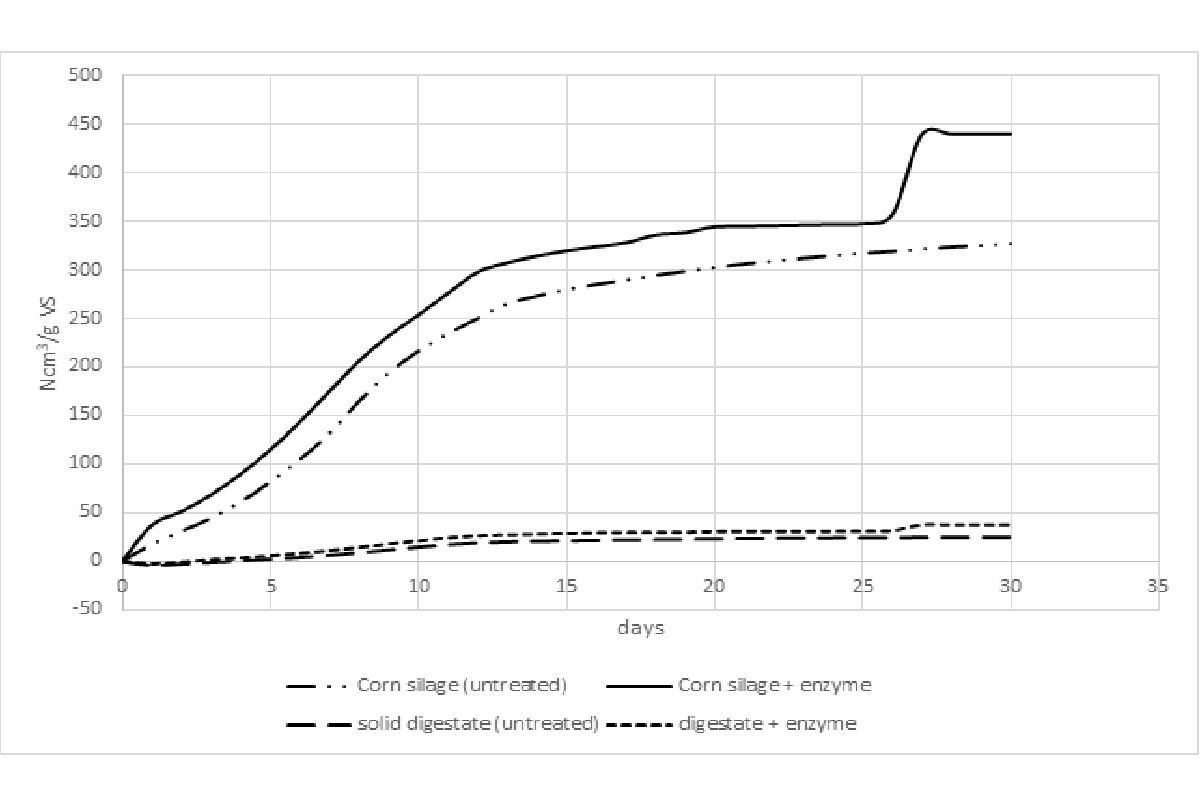
Foto 1: Volume cumulato di metano da insilato di mais e digestato trattati e non trattati con un cocktail di enzimi
(Fonte foto: 4, già citato)
Un'altra esperienza dell'autore (non pubblicata), realizzata con enzimi fungini "grezzi" - cioè disciolti nel brodo di coltura che contiene anche i metaboliti dei funghi - ha dato i risultati mostrati nella Foto 2. In questo caso uno dei campioni (BMMY) conteneva un cocktail di enzimi in grado di aggredire la lignina. Si osserva che tali enzimi hanno consentito un aumento del Bmp spettacolare: +65% rispetto all'insilato non trattato. Gli altri campioni di enzimi, pur producendo un aumento del Bmp significativo (17% e 31% rispettivamente) hanno causato una parziale inibizione del processo, apprezzabile dalla forma concava della curva fra il quinto ed il quindicesimo giorno.
I motivi di tale andamento indesiderato del processo sono molteplici: abbassamento del pH, formazione di composti intermedi che richiedono un certo tempo di adattamento dei batteri, e infine la presenza di metaboliti fungini potenzialmente inibitori (antibiotici).
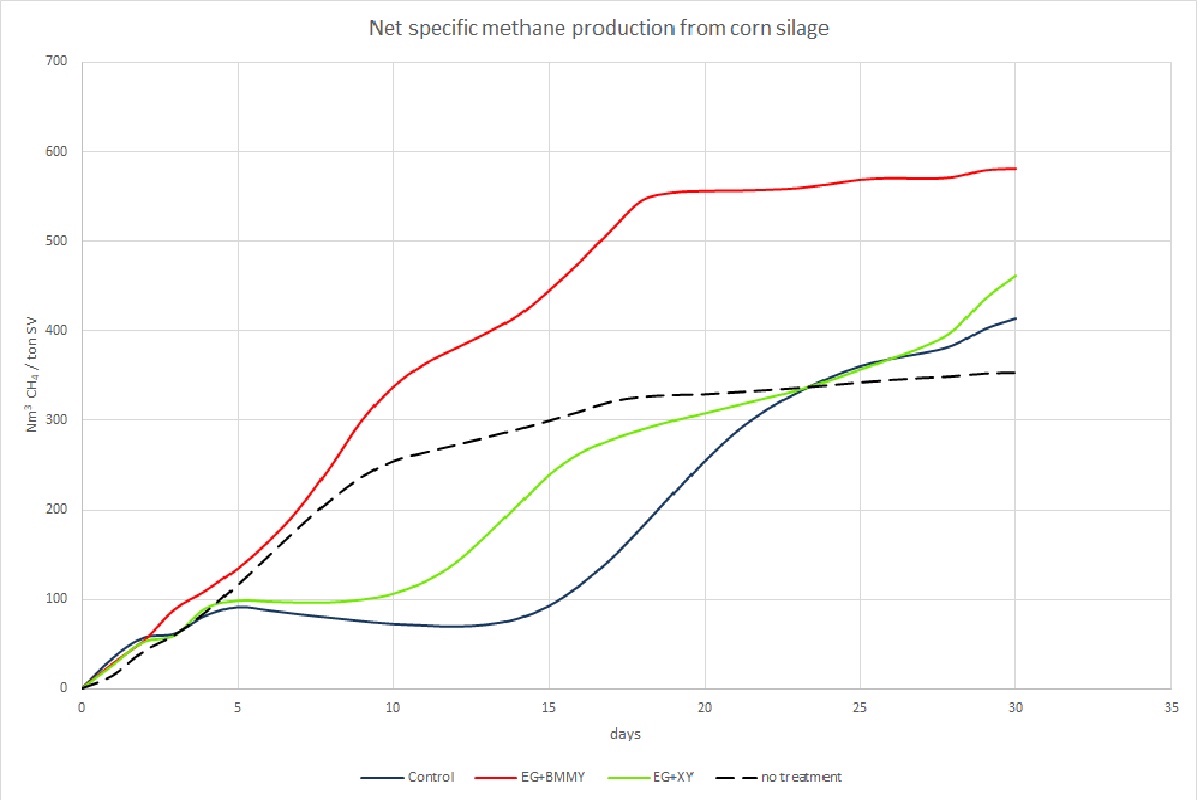
Foto 2: Volume cumulato di metano da insilato di mais non trattato e trattato con diversi cocktail di enzimi fungini. Prove realizzate dall'autore nell'ambito di uno studio in collaborazione con un istituto di ricerca
(Fonte foto: Mario A. Rosato - AgroNotizie®)
Bibliografia
(1) Haruki Ishizaki, Keiji Hasumi, Chapter 10 - Ethanol Production from Biomass, Editor(s): Seishu Tojo, Tadashi Hirasawa, Research Approaches to Sustainable Biomass Systems, Academic Press, 2014, Pages 243-258, ISBN 9780124046092.
(2) Hinterdobler Wolfgang, Li Guofen, Spiegel Katharina, Basyouni-Khamis Samira, Gorfer Markus, Schmoll Monika; Trichoderma reesei Isolated From Austrian Soil With High Potential for Biotechnological Application; Frontiers in Microbiology, Volume 12, 2021.
(3) Rahamim, V.; Nakonechny, F.; Azagury, A.; Nisnevitch, M. Continuous Bioethanol Production by Fungi and Yeast Working in Tandem. Energies 2022, 15, 4338.
(4) Giuliano Degrassi, Rodrigo Hoshino, Milan Koijc, Mariela Catone, Vibha Bhardwaj and Mario A. Rosato; Increased Biomethane Production from Endoglucanase-Pretreated Feedstock; Journal of Research in Environmental Science and Toxicology Vol. 9(1) pp. 1-8, July, 2020.






















