Tra le colture più coltivate al mondo c'è senza dubbio il mais, che solo in Italia occupa 600mila ettari con una produzione che si avvicina ai 7 milioni di tonnellate l'anno (Faostat 2020), produzione concentrata prevalentemente nel Nord della penisola.
La sua notevole estensione, nell'ultimo secolo, è stata però accompagnata da pratiche agricole intensive come la scelta delle monocolture e tecniche di difesa del mais impattanti per l'ambiente.
Il principale problema del mais in campo è la piralide, un lepidottero polifago capace di scavare gallerie nel fusto. A questo fitofago si aggiungono anche gli elateridi, la diabrotica, la recente Sesamia, oltre che i funghi produttori di micotossine. La lotta alla piralide, quindi, non può essere vista come un problema isolato ma deve essere gestita in maniera sistematica, contemporaneamente alla difesa degli altri fitofagi e patogeni. E se sostenibile è meglio.
È di questo che si è parlato durante la lezione del corso di alta formazione Biosolution Academy, dedicata al caso studio della piralide e ai metodi di lotta biologica applicabili per il suo controllo, in particolare l'utilizzo dell'insetto utile Trichogramma. La lezione è stata tenuta da Giovanni Burgio e da Stefano Maini dell'Università degli Studi di Bologna.
Piralide del mais e micotossine
Ostrinia nubilalis è il nome latino del lepidottero diffuso soprattutto a Nord e nel Centro Italia. L'adulto ha un'apertura alare che va dai 25 ai 30 millimetri mentre le larve misurano circa 20-25 millimetri di lunghezza. Compie solitamente 2 generazioni all'anno: le larve della prima generazione attaccano le foglie giovani e il culmo all'inizio dell'estate scavando profonde gallerie che indeboliscono la pianta, le larve della seconda generazione si nutrono delle cariossidi, ad estate inoltrata, compromettendo direttamente la produzione finale.

Larva di Ostrinia nubilalis
(Fonte foto: Università degli Studi di Bologna)
Quando le larve si nutrono delle cariossidi possono favorire la proliferazione di funghi come Aspergillus e Fusarium produttori di micotossine, il cui noto impatto sulla salute umana e animale determina ulteriori perdite economiche significative.
Le micotossine più comuni nel mais in pre-raccolta sono le aflatossine, principalmente prodotte da Aspergillus flavus e A. parasiticus, insieme alle fumonisine prodotte da Fusarium verticillioides e Fusarium proliferatum. Tra le aflatossine, la B1 (AFB1) è considerata il composto naturale più tossico e cancerogeno ed è infatti inserita nella classe 1 come cancerogeno per l'uomo dall'Agenzia Internazionale per la Ricerca sul Cancro (Iarc).
Il rischio micotossine aumenta quando alla combinazione piralide e funghi si aggiungono anche condizioni ambientali avverse come siccità ed elevate temperature.
La difesa della piralide: evoluzione temporale
La lotta chimica nei confronti della piralide è sempre stata molto diffusa tra gli anni '60 e '90. I principali prodotti utilizzati erano il Ddt, vari fosforganici e piretroidi, caratterizzati in maniera diversa da elevata tossicità, impatto ambientale e acaro insorgenza (pullulazioni di acari dannosi a causa della diminuzione di acari e altri insetti predatori in seguito a trattamenti con prodotti ad ampio spettro).
Nel mais da granella l'efficacia dei trattamenti insetticidi non si è mai evidenziata, inoltre deve essere impiegata una macchina irroratrice particolare che può abbattere una certa quantità di piante e dovrebbe bagnare bene anche la pagina inferiore delle foglie di mais. Quindi, non sono mai stati condotti studi su rischio e beneficio dei trattamenti insetticidi nonché nei riguardi degli effetti secondari su insetti utili e sul divieto (anche nel mais) di intervento durante la fioritura.
In contemporanea a partire dalla fine degli anni '60, negli Usa, vengono studiati ibridi ad alta concentrazione di DIMBOA, un benzossazinone presente come glucoside nelle foglie molto giovani di mais. A contatto con la saliva del fitofago il glucoside si idrolizza liberando DIMBOA che è tossico per le larve. Questo è un perfetto esempio di antibiosi, cioè un meccanismo di resistenza genetica che possiede la pianta, ma solamente quando è nelle prime fasi di sviluppo. Con il tempo, però, gli studi su questi ibridi sono stati abbandonati perché le piante risultavano meno produttive degli ibridi convenzionali e in pratica resistenti solo nei confronti delle larve di prima generazione.
Negli anni '70 si punta molto sulle varietà tolleranti al danno cioè varietà con stocchi resistenti all'allettamento e con foglie erette, e parallelamente cominciano le prove con il Bacillus thuringiensis kurstaki, un batterio sporigeno che rilascia una tossina, detta Btk, dannosa per diverse larve di lepidotteri.
Negli anni '80 i trattamenti tradizionali su mais iniziano a essere sconsigliati. Molti prodotti infatti causano acaro insorgenza e si comincia a pensare all'uso del Trichogramma brassicae, un imenottero capace di parassitizzare le uova del fitofago.
Negli anni '90 la lotta alla piralide viene messa in secondo piano e si comincia a parlare dell'uso degli ibridi transgenici Bt cioè mais contenente i geni del Bacillus thuringiensis codificanti per la tossina velenosa. Ma nel 2000, nei paesi in cui il mais Bt non è ammesso, continuano i trattamenti chimici per arginare il crescente problema delle micotossine.
Verso il 2010 si riprende l'utilizzo del Trichogramma favorito dall'uso di droni e integrato con i trattamenti a base di Bacillus thuringiensis.
Ad oggi la strategia migliore resta l'integrazione dei diversi mezzi di lotta. Per la difesa del mais dalla piralide sono consigliati interventi meccanici e agronomici quali l'eliminazione dei residui con macchine trinciastocchi e il loro accurato interramento e la lavorazione del terreno. Importante anche la scelta delle varietà di mais resistenti o tolleranti, l'epoca di semina, la rotazione e la limitazione di estese monoculture. Tra i mezzi di lotta biologica ci sono i lanci con insetti utili come il Trichogramma, di tipo inondativi, effettuati con i droni e trattamenti con preparati microbiologici a base di Bacillus thuringiensis subsp. kurstaki. In caso di forti infestazioni si attua la lotta chimica e i principi attivi utilizzabili sono il clorantraniliprole, l'indoxacarb e lo spinosad.
Sia la lotta chimica che quella biologica devono seguire i criteri della lotta integrata; pertanto, si devono installare, ai margini dei campi, delle particolari trappole sessuali a cono di rete per il monitoraggio e per poter valutare la consistenza della popolazione e i periodi di volo, e cadenzare i trattamenti. Potrebbe essere condotto anche un campionamento delle ovature di piralide. Purtroppo è abbastanza difficile da effettuare e molto dispendioso in termini di tempo. Il monitoraggio con trappole luminose è invece sconsigliato in quanto molti adulti di lepidotteri simili a O. nubilalis produrrebbero confusione e renderebbero gli andamenti di cattura falsi e non sicuri.
Il Trichogramma brassicae è un utile nemico naturale
È un imenottero parassitoide oofago con dimensioni inferiori al millimetro e in grado di parassitizzare le uova di diversi lepidotteri. Il suo utilizzo in lotta biologica è particolarmente vantaggioso perché agisce rapidamente uccidendo il fitofago allo stadio embrionale evitando che le larve nascano, ha una capacità di ricerca elevata, compie più di 1 generazione durante il periodo di ovideposizione della piralide ed è facile da allevare; viene venduto da biofabbriche europee.
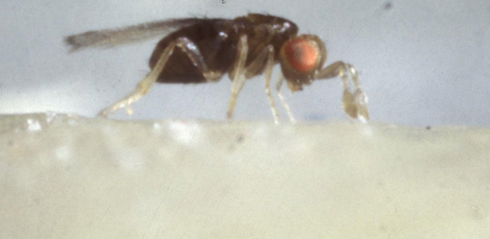
Adulto di Trichogramma brassicae
(Fonte foto: Università degli Studi di Bologna)
Le femmine riescono a trovare le uova da parassitizzare seguendo stimoli visivi e chimici: a lunga distanza sono attratte dalla pianta ospite del fitofago, mentre a breve distanza seguono dei messaggeri chimici, chiamati cairomoni, emessi dal fitofago stesso.
Le masse di uova del fitofago, una volta parassitizzate, diventano scure e nerastre e non vanno confuse con lo stadio testa nera della piralide.
Diverse specie di Trichogramma possono essere già presenti in campo naturalmente. In questo caso svernano come pupa all'interno di uova parassitizzate e in primavera iniziano la loro attività riuscendo a compiere anche più di 10 generazioni. La parassitizzazione naturale risulta più abbondante in tarda stagione cioè nella seconda metà di agosto e inizio settembre, ma studi più recenti hanno evidenziato una discreta parassitizzazione naturale anche ad inizio luglio, probabilmente in conseguenza ai cambiamenti climatici.
Quando il Trichogramma è allevato, invece, viene rilasciato in campo seguendo i criteri della lotta biologica con il metodo inondativo, sottoforma di uova parassitizzate di un lepidottero - ospite di sostituzione - in appositi contenitori biodegradabili sulle piante in campo. I lanci inondativi servono a potenziare la difesa naturale, insufficiente per un controllo soddisfacente e le dosi di lancio vanno dai 200mila ai 300mila individui per ettaro.
Leggi anche
Come funziona la lotta biologica
I lanci di Trichogramma sono compatibili con i trattamenti a base di Bacillus thuringiensis, combinazione che offre la possibilità di effettuare una lotta ovicida e larvicida contemporaneamente. Al contrario, trattamenti con insetticidi chimici non sono compatibili con l'uso del Trichogramma.
Con il tempo l'utilizzo del Trichogramma è stato ripreso soprattutto grazie all'utilizzo delle nuove tecnologie. Se negli anni '80 i lanci venivano eseguiti a mano o con elicotteri, entrambi metodi efficienti ma complessi da organizzare e da realizzare, oggi i protagonisti sono i droni, capaci di facilitare di molto i lanci in campo.
Leggi anche
Droni contro piralide del mais, uno a zero

Drone utilizzato per i rilasci di Trichogramma brassicae
(Fonte foto: Università degli Studi di Bologna)
Come mitigare contemporaneamente il rischio aflatossine
In primis, per gestire il rischio aflatossine è consigliato evitare o ridurre le situazioni di stress per la pianta, utilizzare semine precoci, preparare bene il suolo con le giuste lavorazioni, accelerare le prime tappe del ciclo vegetativo abbreviando il periodo tra semina e fioritura, evitare di ritardare la raccolta e ridurre quanti più possibile il tempo tra raccolta ed essiccazione.
Ma qual è il legame tra piralide e aflatossine? Uno studio condotto dall'Università degli Studi di Bologna, nel periodo 2017-2018, ha valutato l'efficacia di 2 strategie di controllo della piralide nel mais, quella biologica con Trichogramma brassicae e Bacillus thuringiensis e quella chimica convenzionale con clorantraniliprole e ha valutato l'associazione tra la contaminazione da piralide e AFB1.
La lieve riduzione dell'infestazione larvale rispetto al controllo non trattato e alla strategia biologica è stata ottenuta con la lotta chimica convenzionale nonostante non siano state riscontrate differenze significative nella resa di mais tra le 2 modalità di difesa. La strategia biologica, infatti, è risultata comunque un approccio efficace per controllare e limitare la seconda generazione larvale della piralide, senza alcun incremento del livello di AFB1 e perdita di resa.
Lo studio ha evidenziato, inoltre, che nel 2017 nessuna strategia è stata in grado di portare la concentrazione di AFB1 al di sotto della soglia consentita perché l'anno in questione è stato molto favorevole alla produzione di aflatossine, con temperature elevate e forte carenza idrica. Nel 2018, invece, le condizioni erano meno adatte alla diffusione delle aflatossine e il loro livello è risultato significativamente inferiore al limite di sicurezza in tutte le strategie. Un'ulteriore conferma di come lo stress da siccità associato all'alta temperatura sia considerato uno dei fattori più importanti che possono innescare la contaminazione da aflatossine.
Per quanto riguarda la dimostrata efficacia del clorantraniliprolo sulle larve della piralide, è importante sottolineare che altri studi ne riportano gli effetti dannosi su vari insetti utili come Adalia bipunctata, Chrysoperla carnea e Bombus terrestris.
Non solo piralide
Sesamia cretica è una minaccia da non sottovalutare. Questa nottua sta recentemente amplificando i problemi della difesa del mais nel Nord Italia e in particolare in Emilia Romagna. Oltre al mais attacca sorgo e altre graminacee scavando gallerie nel fusto della pianta e nutrendosi della granella, come la piralide. Per distinguere i 2 fitofagi dalle larve a maturità basta osservare la loro grandezza: quelle della Sesamia sono più grandi di quelle della Ostrinia.

Larva di Sesamia cretica
(Fonte foto: Università degli Studi di Bologna)
Differenza tra le larve di Ostrinia nubilalis e Sesamia cretica
(Fonte foto: Univeristà deli Studi di Bologna)
I 2 lepidotteri hanno da sempre condiviso la stessa nicchia ecologica (spazio in cui avvengono tutte le interazioni tra una specie e l’ambiente esterno, cioè fattori biotici e abiotici) e le loro larve si possono rinvenire sulla stessa pianta. Però, perché ultimamente la presenza di Sesamia è aumentata? Questo fitofago, rispetto alla piralide, è meno resistente alle basse temperature e, come sappiamo, gli inverni stanno diventando sempre più miti a causa dell'avanzamento dei cambiamenti climatici. Questa potrebbe essere considerata una delle cause principali legate alla diffusione maggiore, negli ultimi anni, della nottua del mais.
I danni da S. cretica possono provocare gravi perdite produttive, anche superiori a quelle causati dalla piralide, e così come per l'Ostrinia, le gallerie scavate dagli insetti possono essere invase da funghi, che a loro volta causano marciumi della spiga e producono micotossine.
Come ci si può difendere dalla Sesamia? Ad oggi mancano informazioni dettagliate sul suo ciclo biologico, che sarebbero utili per valutare l'efficacia dei mezzi di difesa e stabilire eventuali soglie d'intervento. Purtroppo il Trichogramma non risulta efficace contro S. cretica perché le femmine dell'imenottero non riescono ad entrare nella guaina fogliare dove sono deposte le uova della nottua. Si conoscono, però, altri validi nemici naturali come il dittero tachinide Lydella thompsoni, un endoparassitoide le cui larve neonate penetrano e completano lo sviluppo all'interno di quelle mature di Sesamia e piralide.

Adulto di Lydella thompsoni
(Fonte foto: Università deli Studi di Bologna)
Biosolution Academy è il corso per la formazione di esperti di alto livello nello sviluppo di alternative ai prodotti chimici di sintesi per la difesa delle piante dagli organismi dannosi (biosolution). È organizzato dall'Università Cattolica del Sacro Cuore e si rivolge a dipendenti di aziende che producono e commercializzano biosolution, agronomi, consulenti e studenti.
Obiettivo di Biosolution Academy è quello di formare una nuova figura professionale, che guarda alle biosolution con una conoscenza profonda e trasversale. L'Academy sarà organizzata tramite una didattica innovativa ed esperienziale, con la collaborazione delle aziende del settore, delle migliori competenze dalla ricerca universitaria e dal mondo professionale.
Per informazioni ed iscrizioni visita la pagina del corso.
AgroNotizie® è media partner del corso.


































